
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 )是一种酯类塑化剂,DMP的蒸气对氢气的相对密度为97.工业上生产 DMP的工艺流程如图所示:
)是一种酯类塑化剂,DMP的蒸气对氢气的相对密度为97.工业上生产 DMP的工艺流程如图所示: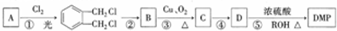
 .
. .
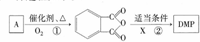
.
查看答案和解析>>
科目: 来源: 题型:解答题
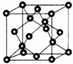 AIN是重要的半导体材料,Ga(镓)、P、As都是形成化合物半导体材料的重要元素.
AIN是重要的半导体材料,Ga(镓)、P、As都是形成化合物半导体材料的重要元素.查看答案和解析>>
科目: 来源: 题型:解答题
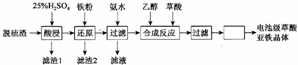
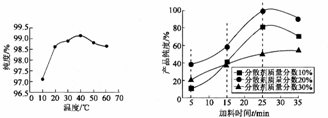
查看答案和解析>>
科目: 来源: 题型:解答题

 .
.
查看答案和解析>>
科目: 来源: 题型:解答题
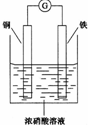 HN03和 HN02是氮的两种重要含氧酸.HN02能被常见的氧化剂(如高锰酸钾、重铬酸钾等)氧化;在酸性条件下也能被亚铁离子、碘离子还原;亚硝酸银( AgN02 )是一种难溶于水、易溶于酸的化合物.回答下列问题:
HN03和 HN02是氮的两种重要含氧酸.HN02能被常见的氧化剂(如高锰酸钾、重铬酸钾等)氧化;在酸性条件下也能被亚铁离子、碘离子还原;亚硝酸银( AgN02 )是一种难溶于水、易溶于酸的化合物.回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
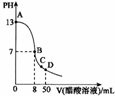 常温下,向25 mL 0.1ml•L-1NaOH溶液中逐滴加入 0.1 mo1•L-1CH3C00H溶液,曲线如图所示,有关粒子浓度关系正确的是( )
常温下,向25 mL 0.1ml•L-1NaOH溶液中逐滴加入 0.1 mo1•L-1CH3C00H溶液,曲线如图所示,有关粒子浓度关系正确的是( )| A. | 曲线上任一点:c(Na+)+c(H+)=c(0H-)+c(CH3C00H) | |
| B. | 在 B点,a=25,且有 c(Na+)=c(CH3C00-)>c(0H-)=c(H+) | |
| C. | 在C点:c(Na+)>c(CH3C00-)>c(H+)>c(0H-) | |
| D. | 在D点:c(CH3C00-)+c(CH3C00H)=2c(Na+) |
查看答案和解析>>
科目: 来源: 题型:选择题
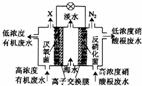 一种三室微生物燃料电池污水净化系统原理如图所示,图中废水有机物可用 C6H10O5表示.下列有关该燃料电池的说法错误的是( )
一种三室微生物燃料电池污水净化系统原理如图所示,图中废水有机物可用 C6H10O5表示.下列有关该燃料电池的说法错误的是( )| A. | 中间室中的 Cl-向左室移动 | |
| B. | 左、右两室溶液混合后所得溶液的酸性:反应前<反应后 | |
| C. | X气体为CO2 | |
| D. | 左边离子交换膜为阴离子交換膜,右边离子交换膜为阳离子交換膜 |
查看答案和解析>>
科目: 来源: 题型:选择题
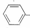 一R能被酸性 KMn04溶液氧化生成
一R能被酸性 KMn04溶液氧化生成 一C00H,但若烷基 R中直接与苯环相连的碳原子上没有 C-H键,则不能被氧化得到一C00H. 现有分子式为 C11H16的一烷基取代苯,则它可以被氧化成为
一C00H,但若烷基 R中直接与苯环相连的碳原子上没有 C-H键,则不能被氧化得到一C00H. 现有分子式为 C11H16的一烷基取代苯,则它可以被氧化成为 一C00H 的同分异构体数目为( )
一C00H 的同分异构体数目为( )| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com