
科目: 来源:2007-2008学年海南东方铁路中学高三第一学期化学期末考试 题型:022
化学平衡常数K表示可逆反应的进行程度,K值越大,表示________,K值大小与温度的关系是:温度升高,K值________(填一定增大、一定减小、或可能增大也可能减小).
查看答案和解析>>
科目: 来源:2007-2008学年海南东方铁路中学高三第一学期化学期末考试 题型:022
液化气中主要成分之一是丁烷(C4H10).在25℃ 101 kPa时,10 kg丁烷完全燃烧生成CO2和H2O放出热量5×105 kJ,丁烷的燃烧热为________,丁烷燃烧的热化学方程式为________________.
查看答案和解析>>
科目: 来源:2007-2008学年海南东方铁路中学高三第一学期化学期末考试 题型:022
把NH4Cl晶体溶入水中,得到饱和NH4Cl溶液.若在该溶液中加入镁条,则观察到有气泡产生,点燃有爆鸣声,此气体是________,产生该气体的原因是________,(用离子方程式表示).微热后,能放出有刺激性气味的气体,它能使湿润的红色石蕊试纸变蓝,该气体是________.
查看答案和解析>>
科目: 来源:2007-2008年北京四中高三年级第一学期期中测验、化学试卷 题型:022
常温下氨气极易溶于水,其水溶液可以导电.
①用方程式表示氨气溶于水的过程中存在的可逆反应
___________________;
②氨水中水电离出的c(OH-)________10-7 mol/L(填写“>”、“<”或“=”);
③将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大到小依次为________.
查看答案和解析>>
科目: 来源:2007-2008年北京四中高三年级第一学期期中测验、化学试卷 题型:022
合成氨工业对化学工业和国防工业具有重要意义.工业合成氨生产示意图如图1所示.
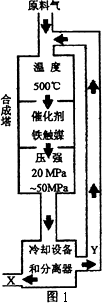
①X的化学式为________;
②图1中条件选定的主要原因是(选填字母序号)________;
A.温度、压强对化学平衡影响
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
③改变反应条件,会使平衡发生移动.如图2表示随条件改变,氨气的百分含量的变化趋势.当横坐标为压强时,变化趋势正确的是(选填字母序号)________,当横坐标为温度时,变化趋势正确的是(选填字母序号)________.
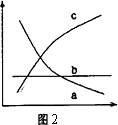
查看答案和解析>>
科目: 来源:2007-2008年北京四中高三年级第一学期期中测验、化学试卷 题型:022
Ⅰ.在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,发生如下反应:
N2(g)+3H2(g)![]() 2NH3(g);ΔH=-92.4 kJ/mol.达到平衡时,体积为反应前的三分之二.求:
2NH3(g);ΔH=-92.4 kJ/mol.达到平衡时,体积为反应前的三分之二.求:
(1)达到平衡时,N2的转化率为________.
(2)若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均为正数,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同.试比较反应放出的能量:(1)________(2)(填“>”、“<”或“=”).
Ⅱ.若将2 mol N2和4 mol H2放入起始体积相同的恒容容器中,在与Ⅰ相同的温度下达到平衡.
试比较平衡时NH3的浓度:Ⅰ________Ⅱ(填“>”、“<”或“=”).
查看答案和解析>>
科目: 来源:2007-2008年北京四中高三年级第一学期期中测验、化学试卷 题型:022
置换反应的通式可以表示为:
单质(1)+化合物(1)=化合物(2)+单质(2)
请写出满足以下要求的3个置换反应的化学方程式:
①所涉及的元素的原子序数都小于20;
②6种单质分属6个不同的主族.
___________________
___________________
___________________
查看答案和解析>>
科目: 来源:2008年普通高等学校招生全国统一考试(上海卷)、化学 题型:022
某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O.
(1)请将Au2O3之外的反应物与生成物分别填如以下空格内.
![]()
(2)反应中,被还原的元素是________,还原剂是________.
(3)将氧化剂与还原剂填入下列空格中,并标出电子转移的方向和数目.
![]()
(4)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为________.
查看答案和解析>>
科目: 来源:2008年普通高等学校招生全国统一考试(上海卷)、化学 题型:022
元素A-D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题.

(1)上表中与A属于同一周期的元素是________,写出D离子的电子排布式________.
(2)D和C形成的化合物属于________晶体.
写出C单质与水反应的化学方程式________.
(3)对元素B的单质或化合物描述正确的是________.
a.B元素的最高正价为+6
b.常温、常压下单质难溶于水
c.单质分子中含有18个电子
d.在一定条件下镁条能与单质B反应
(4)A和D量元素金属性较强的是(写元素符号)________.写出能证明该结论的一个实验事实________.
查看答案和解析>>
科目: 来源:2008年普通高等学校招生全国统一考试(上海卷)、化学 题型:022
四种短周期元素的性质或结构信息如下表.氢根据信息回答下列问题.

(1)B元素在周期表中的位置________,写出A原子的电子排布式________.
(2)写出C单质与水反应的化学方程式________.
A与C形成的化合物溶于水后,溶液的pH________7(填“大于”、“等于”或“小于”).
(3)D元素最高价氧化物晶体的硬度________(填“大于”、“小”),其理由是________.
(4)A、B两元素非金属性较强的是(写元素符号)________.写出证明这一结论的一个实验事实________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com