相关习题
0 95651 95659 95665 95669 95675 95677 95681 95687 95689 95695 95701 95705 95707 95711 95717 95719 95725 95729 95731 95735 95737 95741 95743 95745 95746 95747 95749 95750 95751 95753 95755 95759 95761 95765 95767 95771 95777 95779 95785 95789 95791 95795 95801 95807 95809 95815 95819 95821 95827 95831 95837 95845 203614
科目:
来源:2004年全国普通高等学校招生全国统一考试 化学(广东卷)
题型:038
|
|
孔雀石和石青是自然界存在的两种碳酸盐类铜矿,它们的化学组成可表示为:xCuCO3·yCu(OH)2(x、y为正整数且x≤2,y≤2)
| (1) |
|
孔雀石和石青分别与过量盐酸反应时,孔雀石耗用的盐酸的物质的量与生成的CO2的物质的量之比为4∶1;石青则为3∶1.请推算它们的化学组成.
孔雀石:________;石青:________.
|
|
(2) |
|
现有孔雀石和石青混合样品,取两份等质量的样品,在一份中加入过量盐酸,生成CO23.36 L(标准状况下);加热另一份样品使其完全分解,得到CuO 20 g,试通过计算确定该混合物中孔雀石和石青的物质的量之比.
|
|
|
查看答案和解析>>
科目:
来源:2004年全国普通高等学校招生全国统一考试 化学(广东卷)
题型:038
|
|
维生素C(又名抗坏血酸,分子式为C6H8O6)具有较强的还原性,放置在空气中易被氧化,其含量可通过在弱酸性溶液中用已知溶液的I2溶液进行滴定.该反应的化学方程式如下:
C6H8O6+I2C6H6O6+2HI
现欲测定某样品中维生素C的含量,具体的步骤及测得的数据如下.取10 mL6 mol·L-1 CH3COOH,加入100 mL蒸馏水,将溶液加热煮沸后放置冷却.精确称取0.2000 g样品,溶解于上述冷却的溶液中,加入1 mL淀粉指示剂,立即用浓度为0.05000 mol·L-1的I2溶液进行滴定,直至溶液中的蓝色持续不褪为止,共消耗21.00 mL I2溶液.
| (1) |
|
为何加入的CH3COOH稀溶液要先经煮沸、冷却后才能使用?
|
|
(2) |
|
|
查看答案和解析>>
科目:
来源:2004年普通高等学校招生全国统一考试 化学(上海卷)
题型:038
|
|
黄铜矿(主要成分CuFeS2)是提取铜的主要原料
| (1) |
|
取12.5 g黄铜矿样品,经测定含3.60 g硫(杂质不含硫),矿样中CuFeS2含量为________
|
|
(2) |
|
已知2CuFeS2+4O2 Cu2S+3SO2+2FeO(炉渣) Cu2S+3SO2+2FeO(炉渣)
产物Cu2S在1200 ℃高温下班继续反应:
2Cu2S+3O2→2Cu2O+2SO2
2Cu2O+Cu2S→6Cu+SO2
假定各步反应都完全,完成下列计算:
①由6 mol CuFeS2生成6 mol Cu,求消耗O2的物质的量
②6 mol CuFeS2和14.25 mol O2反应,理论上可得到多少摩尔铜
③6 mol CuFeS2和15.75 mol O2反应,理论上可得到多少摩尔铜
|
|
|
查看答案和解析>>
科目:
来源:2004年普通高等学校招生全国统一考试 化学(上海卷)
题型:038
|
|
氢氧化钡是一种使用广泛的化学试剂.某课外小组通过下列实验测定某试样中Ba(OH)2·nH2O的含量.
| (1) |
|
称取3.50 g试样溶于蒸馏水配成100 mL溶液,从中取出10.0 mL溶液于锥形瓶中,加2滴指示剂,用0.100 mol/L HCl标准溶液滴定至终点,共消耗标准液20.0 mL(杂质不与酸反应),求试样中氢氧化钡的物质的量.
|
|
(2) |
|
另取5.25 g试样加热至失去全部结晶水(杂质不分解),称得质量为3.09 g,求Ba(OH)2·nH2O中的n值.
|
|
(3) |
|
试样中Ba(OH)2·nH2O的质量分数为________.
|
|
|
查看答案和解析>>
科目:
来源:2005年普通高等学校招生全国统一考试、化学
题型:038
|
|
化合物KxFe(C2O4)y·zH2O是一种重要的光化学试剂,其中铁为+3价.分别称取该样品0.491g两份,其中一份在110℃干燥脱水,至质量恒定为0.437g.另一份置于锥形瓶中,加入足量的3mol/LH2SO4和适量的蒸馏水,加热到75℃,趁热加入0.0500mol/L KMnO4溶液24.0mL,恰好完全反应;再向溶液中加入适量的某种还原剂,将Fe3+完全转化为Fe2+,该溶液中Fe2+刚好与4.0mL 0.0500mol/L KMnO4溶液完全反应.通过计算,分别求:
已知:2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
MnO4?/SUP>+5Fe2++8H+=Mn2++5Fe3++4H2O
| (1) |
|
(2) |
|
(3) |
|
|
查看答案和解析>>
科目:
来源:2005年普通高等学校招生全国统一考试、化学
题型:038
某研究性学习小组欲用化学方法测量一个不规则容器的体积.把35.1gNaCl放入500mL烧杯中,加入150mL蒸馏水.待NaCl完全溶解后,将溶液全部转移到容器中,用蒸馏水稀释到完全充满容器.从中取出溶液100mL,该溶液恰好与20mL 0.100mol/L AgNO3溶液完全反应.试计算该容器的体积.
查看答案和解析>>
科目:
来源:浙江省杭州市2004—2005学年度高三年级质量检测 化学试卷
题型:038
|
|
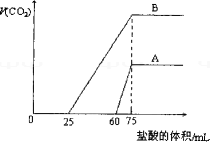
取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol·L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之的关系如图所示,试回答下列问题:
| (1) |
|
原NaOH溶液的物质的量浓度为________mol·L-1
|
|
(2) |
|
曲线A表明,原NaOH溶液中通入CO2后,所得溶液中的溶质为(写化学式)________;其物质的量之比为________.
|
|
(3) |
|
曲线B表明,原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气本体积(标准状况)的最大值为________mL.
|
|
|
查看答案和解析>>
科目:
来源:浙江省杭州市2004—2005学年度高三年级质量检测 化学试卷
题型:038
|
|
如图为某市售盐酸试剂瓶标签上的部分数据.

| (1) |
|
(2) |
|
取该盐酸25.4mL与2.00mol/L的氢氧化钠溶液100mL混合,再将混合后液稀释至1.00L.此时溶液的pH约为多少?
|
|
|
查看答案和解析>>
科目:
来源:海淀区2005年高三年级第一学期期末练习 化学
题型:038
|
|
已知反应: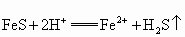 
| (1) |
|
将24g铁粉和8g硫粉混合均匀,在隔绝空气条件下加热使之充分反应.然后往反应产物中加入足量稀硫酸,产生气体的体积在标准状况下(忽略气体的溶解)为________L;若使该气体完全燃烧,消耗标准状况下空气的体积为(空气中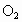 的体积分数为0.20)________L. 的体积分数为0.20)________L.
|
|
(2) |
|
将ag铁粉和bg硫粉混合均匀,在隔绝空气条件下充分加热.然后往反应产物中加入足量稀硫酸,将产生的气体完全燃烧,消耗标准状况下的空气VL,则V的取值范围是________.
|
|
|
查看答案和解析>>
科目:
来源:海淀区2005年高三年级第一学期期末练习 化学
题型:038
|
|
欲测定某铝铜合金的组成,进行了如下实验:称取粉末状样品1.0g,量取某浓度的盐酸20mL,第一次往样品中加入盐酸10mL,收集到标准状况下的气体224mL.然后,再往样品中加入盐酸10mL,又收集到标准状况下的气体112mL.
| (1) |
|
(2) |
|
|
查看答案和解析>>
