
科目: 来源:山东省济宁市汶上一中2012届高三11月月考化学试题 题型:022
阿司匹林(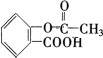 )具有解热、镇痛、抗炎、抗风湿和抗血小板聚集等多方面的药理作用,是应用最早、最广和最普通的解热镇痛药.
)具有解热、镇痛、抗炎、抗风湿和抗血小板聚集等多方面的药理作用,是应用最早、最广和最普通的解热镇痛药.
(1)阿司匹林的分子式是________,含氧官能团的名称是________、________.
(2)写出阿司匹林跟足量NaOH溶液反应的化学方程式:________
(3)水杨酸的分子式是C7H6O3,跟乙酸酐(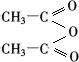 )在催化剂作用下生成阿司匹林.则水杨酸的结构简式是________,该制取反应的反应类型是________.
)在催化剂作用下生成阿司匹林.则水杨酸的结构简式是________,该制取反应的反应类型是________.
(4)同时符合下列条件的水杨酸的同分异构体有________种.
①分子中有苯环;
②能跟银氨溶液反应生成银镜;
③苯环上的一硝基取代物有2种.写出其中任一种的结构简式________.
(5)一种缓释阿司匹林的结构式如下:
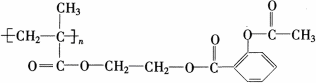
该物质在酸性条件下水解生成阿司匹林、乙二醇和一种聚合物.这种聚合物的单体的结构简式是________.
查看答案和解析>>
科目: 来源:吉林省长春市十一中2012届高三上学期期中考试化学试题 题型:022
X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,Z分别与X,Y形成B、C两种电子数均等于10的分子且一个B分子中含有的Z原子个数比C分子中少1个请回答下列问题:
(1)Y元素在周期表中的位置是________周期________族.
(2)B的电子式是________,B与C反应的化学方程式为________.
(3)由X、Y、Z形成组成化合物Z4Y2X3的化学键类型是________,其水溶液中各离子浓度大小关系是________
(4)已知Y单质与Z单质生成C的反应是可逆反应,ΔH<0.若X、Z、C的起始浓度分别用a mol/L、b mol/L、c mol/L表示,且a、b、c均不为0,在一定条件下,达到平衡时测得c(Y)=0.5 mol/L、c(Z)=0.3 mol/L、c(C)=1.6 mol/L.则:
①a、b应满足的关系:________
②a的取值范围:________
③将等物质的量的Y、Z两种单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应.下列说法正确的有________.
a.达到化学平衡时,正反应速率与逆反应速率相等
b.反应过程中,Y单质的体积分数始终为50%
c.达到化学平衡时,Y、Z两种单质在混合气体中的物质的量之比为1∶1
d.达到化学平衡后,升高温度,C的体积分数减小
查看答案和解析>>
科目: 来源:四川省成都石室中学2012届高三上学期期中考试理综化学试题 题型:022
Ⅰ、2001年诺贝尔化学奖被美国的诺尔斯、夏普雷斯和日本的野依良治获得,他们发现了某些手性分子可用作某些化学反应的催化剂,为合成对人类有用的重要化学物开辟了一个全新的研究领域.在有机物分子中,若某个碳原子连接4个不同的原子或基团,则这种碳原子称为“手性碳原子”,如 中带*的C原子.若同一个碳原子上连着2个碳碳双键(如C=C=C)时,分子极不稳定,不存在.某链烃C7H10c的众多同分异构体中:
中带*的C原子.若同一个碳原子上连着2个碳碳双键(如C=C=C)时,分子极不稳定,不存在.某链烃C7H10c的众多同分异构体中:
(2)处于同一平面上的碳原子数最多有________.
A.6个
B.5个
C.7个
D.4个
(3)含有“手性碳原子”,且与足量H2发生加成反应后仍具有“手性碳原子”的有5种.它们的结构简式除![]() 、
、![]() 、
、![]() 3种外,还有________、________.
3种外,还有________、________.
(3)含有“手性碳原子”,但与足量H2发生加成反应后,不具有“手性碳原子”的结构简式是________
Ⅱ、乙烷与某烃的混合气体1.344 L(标准状况)与足量的氧气混合点燃,完全燃烧后所得气体通入300 mL 0.4 mol·L的NaOH溶液中被全部吸收,然后将吸收液低温蒸干,得固体7.6 g.
(1)7.6 g固体的成分是________.
(2)该混合气体中除C2H6外,另一种烃是________.
(3)该混合气体中C2H6,队的物质的量是________,另一种烃的物质的量是________.
(4)若将该混合气体在足量氧气中完全燃烧后的产物通过足量的Na2O2粉末,Na2O2粉末增重的质量为________.
查看答案和解析>>
科目: 来源:四川省成都石室中学2012届高三上学期期中考试理综化学试题 题型:022
Ⅰ、用”>“、“=’’或“<"符号表示以下各问中量的关系.
(1)pH相同的氨水、氢氧化钠和氢氧化钡溶液,分别用蒸馏水稀释到原来的X倍、Y倍、Z倍,稀释后三种溶液的pH仍相同,则X、Y、Z之间大小的关系是________.
(2)相同体积、相同物质的量浓度的氨水、氢氧化钠和氢氧化钡三种稀溶液与盐酸完全反应,消耗同浓度的盐酸的体积分别为V1、V2、V3,则三者关系为________.
(3)相同温度、相同物质的量浓度的七种溶液:
①H2SO4,
②NaCl,
③NaHSO4,
④CH3COOH,
⑤NH3H2O,
⑤NaOH,
⑦Ba(OH)2.
按pH由大到小的顺序排列,正确顺序是(填写编号)________
Ⅱ、在一容积固定的反应器中,有一可左右滑动的密封隔板,两侧分别进行如图所示的反应.
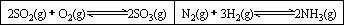
(1)若起始时左侧投入2 mol SO2、1 mol O2,右侧投入1 mol N2、4 mol H2,达到平衡后,隔板是否可能处于中央位置?________(填“可能”或“不可能”).
(2)若起始时左侧投入2 mol SO2、1 mol O2,右侧投入1 mol N2、2 mol H2,达到平衡后,隔板处于中央位置,则SO2的转化率与N2的转化率之比为________.
(3)若起始时左侧投入2 mol SO2、1 mol O2,右侧投入1 mol N2、a mol H2且起始时右侧体积小于左侧体积,调节反应器至某一温度(两侧温度相同),使平衡时隔板处于中央位置,此时SO2的转化率与N2的转化率之比为5∶1,则a的取值范围为________.
查看答案和解析>>
科目: 来源:四川省成都石室中学2012届高三上学期期中考试理综化学试题 题型:022
A、B、C、D、E五种短周期元素,其原子序数依次增大,而原子半径按A、C、B、E、D顺序依次增大.A、D同主族;C、D、E三种元素原子的最外层电子数之和为10,C原子电子数比E原子电子数少5个.B的单质分子中有三对共用电子.
请回答下列问题:
(1)A、C两元素形成的原子个数比为1∶1,且呈电中性的微粒的电子式为________、________.
(2)A、C、D可形成化合物W,其含有的化学键有________,以W溶液作为电解质溶液,E棒与铁棒分别作为电极构成原电池,则负极的电极反应式为________以铁棒为电极,W溶液为电解液构成电解池,则阴极的电极反应为________.
(3)A2和B2在工业上可合成一种重要的原料BA3.
①下列的措施有利于提高B2的转化率的是________
A.釆用20~50 MPa的大气压
B.选用400~500℃的高温
C.使用催化剂
D.及时将BA3液化
②现有甲、乙两个同定体积的容器,在相同的体积和温度下,甲中充入2 mol BA3,反应达到平衡时,吸收Q1 kJ的能量;乙中充入1 mol B2和3 mol A2,反应达到平衡时,放出Q2 kJ的能量;合成BA3的热化学方程式为________
(4)用D2C2在酸性条件下处理含CN-的工业废水,将得到N2及CO2等物质,请写出该反应的离子方程式________.
查看答案和解析>>
科目: 来源:甘肃省张掖中学2012届高三第二次月考化学试题 题型:022
| |||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:江苏省阜宁高级中学、大丰高级中学、栟茶高级中学2012届高三第二次调研联考化学试题 题型:022
NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得.操作步骤如下:
①用稀硫酸溶液溶解废渣,保持pH约1.5,搅拌30 min,过滤.
②向滤液中滴入适量的Na2S,除去Cu2+、Zn2+,过滤.
③保持滤液在40℃左右,用6%的H2O2氧化Fe2+,再在95℃加入NaOH调节pH,除去铁和铬.
④在③的滤液中加入足量Na2CO3溶液,搅拌,得NiCO3沉淀.
⑤________.
⑥________.
⑦蒸发、冷却结晶并从溶液中分离出晶体.
⑧用少量乙醇洗涤并凉干.
(1)步骤②除可观察到黑色沉淀外,还可嗅到臭鸡蛋气味,用离子方程式说明气体的产生:________.
(2)步骤③中,加6%的H2O2时,温度不能过高,其原因是:________.
(3)除铁方法有两种,一是用H2O2作氧化剂,控制pH值2~4范围内生成氢氧化铁沉淀;另一种方法常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去.下图是温度-pH值与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域(已知25℃时,Fe(OH)3的Ksp=2.64×10?39).
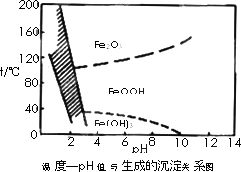
下列说法正确的是________(选填序号).
a.FeOOH中铁为+2价
b.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10?29
c.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO![]() +6H+=6Fe3++Cl-+3H2O
+6H+=6Fe3++Cl-+3H2O
d.工业生产中温度常保持在85~95℃生成黄铁矾钠,此时水体的pH约为1.2~1.8
(4)确定步骤④中Na2CO3溶液足量,碳酸镍已完全沉淀的简单方法是:________.
(5)补充上述步骤⑤和⑥(可提供的试剂有6 mol/L的H2SO4溶液,蒸馏水、pH试纸).
查看答案和解析>>
科目: 来源:江苏省启东中学2012届高三上学期期中考试化学试题 题型:022
饮用水中含有一定浓度的NO3-将对人类健康产生危害,NO3-能氧化人体血红蛋白中的Fe(Ⅱ),使其失去携氧功能.为了降低饮用水中NO3-的浓度,某兴趣小组提出如下方案:
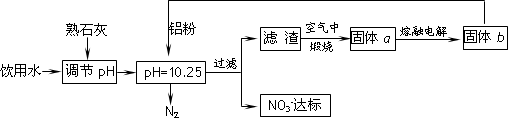
请回答下列问题:
(1)已知过滤后得到的滤渣是一种混合物,则在溶液中铝粉和NO3一反应的离子方程式为________.
(2)该方案中选用熟石灰调节pH,理由是________、________,在调节pH时,若pH过大或过小都会造成________的利用率降低.
(3)用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为________.
(4)饮用水中的NO3-主要来自于NH4+.已知在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-.两步反应的能量变化示意图如下:
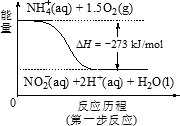
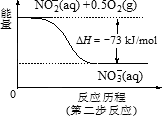
试写出1 mol ![]() (aq)全部氧化成NO3-(aq)的热化学方程式是________.
(aq)全部氧化成NO3-(aq)的热化学方程式是________.
查看答案和解析>>
科目: 来源:吉林省白山市友好学校2012届高三12月联考化学试题 题型:022
A、Y为常见金属单质,X为常见非金属单质.常温下X、G、H、I为气体,C为液体.B是由三种元素组成的盐,加热时发生分解生成两种气体,冷却后又可化合得到B.有关物质之间的转化关系如下图(部分反应条件及生成物略去)
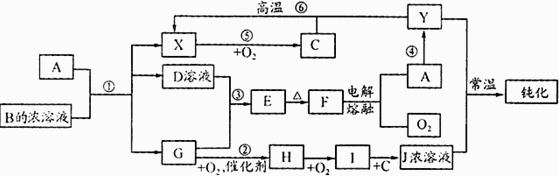
请填写下列空白:
(1)B的电子式为________;
(2)D固体可用于净水,请用相应的离子方程式及简单文字说明原因:________;
(3)反应⑥的化学方程式为________;
反应④在冶金工业上属于________(填金属的冶炼方法);
(4)从D的结晶水合物制备D的无水晶体的操作为________;
(5)反应②的化学方程式为________;反应③的离子方程式为________;
(6)收集一试管H,将其倒置于水槽中,然后向试管中通入一定量的O2使试管内液面上升,最终剩余气体占试管容积的一半,则原有H与所通入O2的体积比为________.
查看答案和解析>>
科目: 来源:62A22340_浙江省五校2012届高三第一次联考化学试题.doc 题型:022
已知有机物A分子由C、H、O三种元素组成,其相对分子质量为120,0.1 mol A在足量的氧气中充分燃烧后生成0.8 mol CO2和7.2 g H2O;A可以发生银镜反应,其苯环上的一卤代物有三种.
(1)A的分子式是________,A中含氧官能团的名称是________,A的结构简式为________.
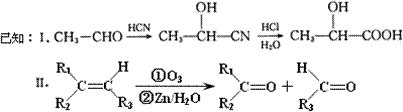
现有如下转化关系:
![]()
其中D能使溴的四氯化碳溶液褪色,F继续被氧化生成G,G的相对分子质量为90.
(2)C可能具有的化学性质有________(填序号).
①能与H2发生加成反应;
②能在碱性溶液中发生水解反应;
③能与甲酸发生酯化反应;
④能与Ag(NH3)2OH溶液发生银镜反应;
⑤能与氢氧化钠溶液反应
(A)①②③
(B)①③⑤
(C)①②③⑤
(D)②③④⑤
(3)①写出C→D的化学反应方程式________;反应类型为________;
②在催化剂条件下,C生成高聚物的化学方程式________;
③G与足量NaHCO3溶液反应的化学方程式________.
(4)C的同分异构体有多种,其中符合下列要求的有机物有两种:
①属于酯类化合物;
②遇三氯化铁溶液显紫色;
③与新制氢氧化铜悬浊液共热可生成红色沉淀;④苯环上的一卤代物只有一种
写出其中一种有机物的结构简式________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com